-
电话:19390038897
-
微信:2777177595
-
QQ:2777177543QQ:2777177543
-
邮箱:2777177543@qq.com

我们通过M-β-CD处理细胞,破坏细胞表面的脂筏结构,对比正常细胞和经M-β-CD处理后的细胞顶端膜上的分布变化,进而得出了脂筏存在对糖分子分布的影响。所研究的糖分子包括Sia、oligosaccharide (Galβ1-4GlcNAcβ1-2 (Galβ1-4GlcNAcβ1-6) Manα1-R)、Fuc、Man、Gal、和GalNAc。相比正常细胞表面的糖分子分布形貌(图1A-F-左),我们发现在胆固醇被抽提的细胞表面(图1A-F-右),无论哪种类型的糖分子都发生了显著的分布变化:从原始的重构图上点分布的强度变化可以明显看出,随着脂筏被破坏,大量的糖分子分布减少;另外,从放大的超分辨图像上,能够更加清晰地观察到这些糖分子簇明显减少、变小,取而代之的是更多的散点分布。各糖分子都有的巨大分布变化以及它们统一的变化趋势表明了细胞膜上所有类型的糖分子簇的稳定存在都和脂筏的完整存在有着密不可分的联系。
为阐明肌动蛋白骨架是否在控制糖分子簇大小方面起着重要作用,我们观察了细胞骨架被破坏后,细胞表面糖分子的分布变化。通过CB处理Vero细胞使其肌动蛋白骨架结构被破坏,进而利用dSTORM成像技术观察了破坏后的糖分子分布形态。对比正常细胞膜表面的七种糖分子分布的超分辨重构图(图2A-G-左),很明显地,在骨架被破坏的细胞表面,大多数类型的糖分子簇分布都失去了清晰的边缘,面积增大,彼此相连。进一步,通过成对累积分布函数(pairwise cumulative distribution function,CDF)分析方法对膜上糖分子的分布进行了检测。理论上,单分子定位成对距离的CDF会随着密实结构域的纳米结构发生变化。在给定的空间距离内,有着大尺度成簇的数据其成对距离会小于那些小尺度成簇的。也就是说,CDF曲线会随着分子成簇距离的增大而向右移动。从我们的分析结果来看(图2H),CB处理后,有着密实成簇的糖分子(Sia,oligosaccharide,Fuc和GlcNAc)的CDF发生了明显的右移;而松散成簇的糖分子的CDF也发生了轻微右移。这一结果表明在失去了肌动蛋白骨架的限制作用后,糖分子不再聚集在特定区域而是分散在更大的几乎无边界的块斑中,特别是对于那些原本密实成簇的糖分子。另外,我们也应用了改善的Hopkin检测对这些超分辨中的纳米结构域的图心进行了分析。Hopkin统计分析的结果和CDF的是类似的。正常细胞和骨架被破坏的细胞表面糖分子分布的Hopkin函数值之间的明显差异表明没有了肌动蛋白骨架的限制,糖分子变得稀疏地分散在更大的块斑中。

图1:多种糖分子在正常Vero细胞和经M-β-CD处理后的细胞顶端膜上的超分辨图。(A-F)通过Alexa647偶联的不同lectins作为特异性的荧光探针标记被充分固定的正常的(左)和经M-β-CD处理的Vero细胞(右),得到的各糖分子的代表性dSTORM重构图。目标糖分子依次为:Sia(A)、oligosaccharide(B)、Fuc(C)、Man(D)、Gal(E)、GalNAc(F)。来自原始重构图中方框区域的放大图更加清晰地呈现了糖分子簇形态变化。原始重构图中标尺为5 μm;放大图中标尺为500 nm。
另外,我们也统计分析了骨架被破坏后糖分子簇的平均簇面积和簇覆盖率的变化情况(图3),发现每种糖分子随着骨架限制作用的消失都表现出了明显的簇面积增大和簇覆盖率增加。这也再次表明了肌动蛋白骨架结构对糖分子簇的特定大小发挥着限制作用。
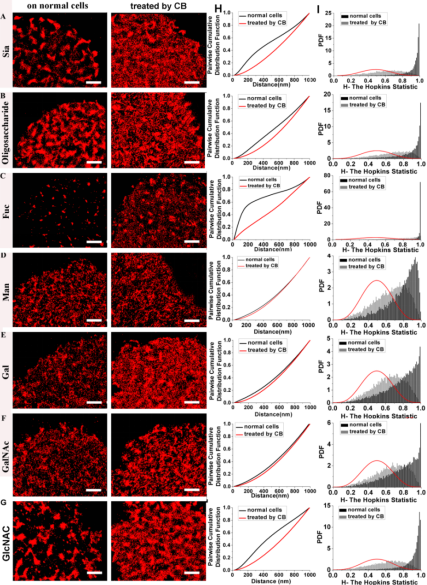
图2. 各种糖分子在正常细胞和经CB处理后的细胞表面分布变化的对比分析。(A-G)糖分子(Sia (A), oligosaccharide (B), Fuc (C), Man (D), Gal (E), GalNAc (F)和GlcNAc (G))在正常细胞(左)和处理后的细胞(右)表面分布的代表性dSTORM重构图,标尺为2 μm。(H)七种糖分子在正常细胞和CB处理后的细胞表面分布的成对累积分布函数(CDF)对比图。(I)对目标糖分子簇中心的空间随机性的改善性Hopkin检测结果图。红色函数曲线表示的是随机分布,其峰值所对应的Hopkin统计值为0.5。
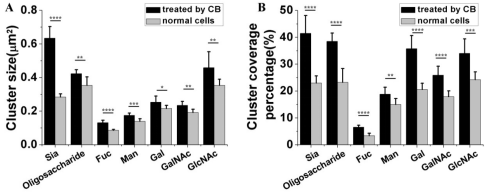
图3. 正常细胞和经CB处理后的细胞表面各糖分子的平均簇面积(A)和簇覆盖率(B)的对比分布图。
利用dSTROM成像技术,我们系统地研究了七种代表性糖分子在不同的正常细胞和癌细胞表面的分布形态。相比293FT(人胚肾细胞)细胞表面,这些所研究的糖分子在Os-Rc-2(人肾癌细胞)细胞表面不仅有着更高的表达水平,而且呈现出独特的分布形态(尤其是以更大的簇面积和更高的簇覆盖率分布),这表明这些有着独特分布的糖分子能够作为肾癌细胞的潜在生物标记物。另外,由于Sia在293FT/Os-Rc-2细胞的研究中呈现出中等水平的分布差异,被选作代表性糖分子进行了Sia在原代肾癌细胞和正常肾细胞表面的分布成像,发现在多个分析参数上,临床生物样品所得结果均和细胞系的没有差异,这表明目标糖分子的显著性分布差异有很大潜力成为新颖的临床癌症检测的标记物。此外,大多数目标糖分子(如oligosaccharide、Sia、GlcNAc、Gal和GalNAc)在Hela细胞(人宫颈癌细胞)和Os-Rc-2细胞表面都有着相似的分布形态,这表明糖分子在癌细胞上的异常分布很可能是不同癌细胞共有的特征。我们进一步选择了有着中等水平分布差异的Sia作为代表性糖分子,研究了其在多种正常细胞和癌细胞表面的分布特征,发现相比不同的正常细胞,Sia在不同的癌细胞表面均表现出了相似的簇面积增大和簇覆盖率升高的分布趋势。然而,细胞表面糖分子的表达水平和簇密度却没有在多种正常细胞和癌细胞间表现出明显的变化规律,因此,一些传统的分析方法(如质谱和普通的荧光成像)并不能检测到癌症相关的糖分子变化。而我们的发现表明有着超高分辨率的dSTORM成像技术能够检测到多种癌细胞表面的糖分子分布差异,从而基于癌细胞表面糖分子独特的分布特征(尤其是簇大小和簇覆盖率)能够更好地确定肿瘤的发生。再者,这些癌症相关的糖分子异常分布来源于癌细胞膜上糖缀合物组装的整体改变,这表明癌症相关的改变很可能表现在配体的密度、反应分子的可接触性、功能蛋白或脂类的构象或寡聚化的变化等等。因此,癌细胞形成正常细胞上极少出现或根本不会出现的独特膜组装很可能是为了促进癌症的发生与转移。尽管这些推测还有待进一步验证,但我们关于癌症相关的糖分子异常分布的发现确实可以为癌症的研究提供一些新观点新思路,这也将促进对癌症发生和转移中糖基化改变的潜在机理的研究。
